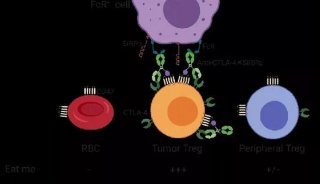
CTLA4依賴性反饋環的破壞可促進腫瘤相關Treg細胞過度增殖
檢查點阻斷免疫療法(Checkpoint blockade immunotherapy, CBI)通過抑制細胞毒性T淋巴細胞相關蛋白4(CTLA-4)和PD-1等分子與其配體的相互作用,增強抗腫瘤免疫應答,這使得一部分預后不佳的癌癥患者能夠長期無進展生存【1】。然而, 免疫檢查點只是在腫瘤微環境(TME)中對抗免疫介導的癌細胞消除的多層調節機制系統的一個組成部分,將CBI擴展到更多患者可能需要同時針對其他免疫調節機制。其中,Treg細胞活性構成了另一層免疫調節,包括調節APC細胞功能、分泌抑制性細胞因子等【2】。因此,靶向Treg細胞是改善癌癥治療的重要因素。
在癌癥患者中,已經進化出一種機制來調節免疫反應的程度和持續時間以防止過度的致病性免疫激活,但這一機制也將阻礙癌細胞的清除。Treg細胞對激活的效應T細胞產生的IL-2的依賴性,將Treg細胞的激活和擴張與效應反應的大小聯系起來。Treg細胞建立腫瘤耐受性的能力取決于其在TME中的浸潤和局部同源抗原接觸【3】,這表明它們的功能需要通過TCR信號或在抗原依賴性細胞相互作用過程中接收的其他信號持續維持。有趣的是,從人類腫瘤中分離出來的Treg細胞能表達反映細胞活化的基因,而這些基因的表達依賴于TCR識別。然而,Treg細胞是在廣泛的腫瘤相關APC上不分青紅皂白地識別同源抗原,還是通過與特定亞群相互作用來識別其同源抗原,這一問題尚未被研究。
近日,來自美國麻省綜合醫院的Thorsten R. Mempel和Francesco Marangoni團隊在Cell雜志上合作發表了一篇題為 Expansion of tumor-associated Treg cells upon disruption of a CTLA-4-dependent feedback loop 的文章,在這項研究中,作者通過多光子活體顯微鏡(MP-IVM)和T細胞激活核因子(Nuclear Factors of activated T cells, NFAT)熒光報告系統來直接觀察Treg細胞在TME中如何接收TCR信號。研究證明,Treg細胞通過CTLA-4和CD28依賴的反饋環自我調節,調節其群體大小以適應局部共刺激的程度,這種Treg軸的破壞對于阻斷腫瘤耐受和增強CTLA-4阻斷的效果至關重要。

為了解決上述問題,作者應用NFAT-GFP融合作為TCR熒光報告系統以通過體內成像檢查腫瘤組織中Treg細胞活化的單細胞動力學【4】,隨后應用一種Treg細胞強烈抑制抗腫瘤免疫的小鼠模型(MC38 H2B-Cer)【5】,并進行MP-IVM分析,過繼轉移的Foxp3+Treg細胞和Foxp3-Th細胞在腫瘤中積聚(圖1)。通過觀察,作者發現與Tregs相比,幾乎所有Th細胞都以高速遷移,沒有停滯,表明多克隆Treg細胞庫是被預先富集以識別腫瘤相關的傳統樹突狀細胞(cDCs)所呈遞的抗原,而大多數Th細胞并不能識別這些抗原。如果消除cDCs,同時使用功能性 S1P 受體拮抗劑 FTY720 阻斷淋巴細胞從次級淋巴器官(SLO)流出,可以觀察到腫瘤相關Treg細胞豐度降低,增殖減少,且其活化標記物如CTLA-4的表達進一步降低,提示cDCs在局部Treg細胞活化和維持其在TME中群體大小中的作用。
此外,作者還觀察到,Treg和Th細胞如何與呈遞同源抗原的APC相互作用的差異不是由TCR親和力的內在差異驅動的,而主要是由Treg細胞進入TME引起的變化驅動的,包括改變的APCs功能。那么Treg細胞如何影響Th細胞與APCs的相互作用呢?考慮到先前報道的Treg細胞可以利用CTLA-4減少SLO中APCs上的CD80和CD86的數量,以及腫瘤浸潤性Treg細胞上CTLA-4的高表達【6】,作者假設Treg細胞通過降低APCs共刺激能力來負調節腫瘤中T細胞與APCs相互作用的穩定性。為了驗證這個假設,作者使用CTLA-4抗體4F10來阻斷CTLA-4功能,與預期一致,觀察到cDCs上的CD80/CD86表達增加,表明CTLA-4限制了CD80和CD86在腫瘤浸潤cDCs上的表達,從而限制了局部Treg細胞的增殖。
先前研究已經報道Treg細胞的發育和外周穩態需要CD28以維持其在TME中的功能。那么Treg細胞是否是通過CTLA-4調節APC上CD28配體CD80/CD86的密度來限制自身在效應位點的增殖呢?為此,作者研究了CD28缺陷的Treg細胞對TME中CTLA-4阻斷的反應,在CD28lo小鼠中的Treg細胞增殖率顯著低于CD28hi小鼠,表明在TME中需要CD28來維持Treg細胞的增殖。
Treg細胞利用CTLA-4作為小鼠和人類免疫抑制的核心機制,因此,在CTLA-4抗體阻斷后,Treg細胞可能已經失去了限制抗腫瘤免疫反應的能力,那么在這種情況下,它們的增殖也變得無關緊要。然而,Treg細胞控制著多種替代抑制機制【2】,這些替代的免疫抑制功能是否限制了CTLA-4阻斷劑的治療性抗腫瘤療效呢?為此,作者通過三苯氧胺處理Foxp3creERT2 x CnBf/f MC38荷瘤小鼠,通過敲除CnB來阻止Treg細胞活化。先前報道指出,使用CTLA-4抗體4F10會引起MC38腫瘤進展輕微延遲,而此實驗4F10和Treg細胞失活聯合會導致超過三分之一的動物中MC38腫瘤消失。也就是說,盡管Treg細胞利用CTLA-4抑制抗腫瘤免疫,但在CTLA-4阻斷后,Treg細胞部署了替代的抑制機制來繼續阻礙腫瘤的清除。

總的來說,這項腫瘤微環境的活體成像研究提供了關于Treg細胞如何通過CTLA-4和CD28依賴的負反饋環調節其數量以及與樹突狀細胞的相互作用的見解。對癌癥免疫治療精確機制的理解是持續改進臨床治療手段的基礎。
參考文獻
1. Borghaei, H., Paz-Ares, L., Horn, L., Spigel, D.R., Steins, M., Ready, N.E., Chow, L.Q., Vokes, E.E., Felip, E., Holgado, E., et al. (2015). Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N. Engl. J. Med. 373, 1627–1639.
2. Vignali, D.A.A., Collison, L.W., and Workman, C.J. (2008). How regulatory T cells work. Nat. Rev. Immunol. 8, 523–532.
3. Bauer, C.A., Kim, E.Y., Marangoni, F., Carrizosa, E., Claudio, N.M., and Mempel, T.R. (2014). Dynamic Treg interactions with intratumoral APCs promote local CTL dysfunction. J. Clin. Invest. 124, 2425–2440.
4. Aramburu, J., Garcia-Co ′ zar, F., Raghavan, A., Okamura, H., Rao, A., and Hogan, P.G. (1998). Selective inhibition of NFAT activation by a peptide spanning the calcineurin targeting site of NFAT. Mol. Cell 1, 627–637
5. Arce Vargas, F., Furness, A.J.S., Litchfield, K., Joshi, K., Rosenthal, R., Ghorani, E., Solomon, I., Lesko, M.H., Ruef, N., Roddie, C., et al.; TRACERx Melanoma; TRACERx Renal; TRACERx Lung consortia (2018). Fc Effector Function Contributes to the Activity of Human Anti-CTLA-4 Antibodies. Cancer Cell 33, 649–663.e4.
6. Ovcinnikovs, V., Ross, E.M., Petersone, L., Edner, N.M., Heuts, F., Ntavli, E., Kogimtzis, A., Kennedy, A., Wang, C.J., Bennett, C.L., et al. (2019). CTLA-4 -mediated transendocytosis of costimulatory molecules primarily targets migratory dendritic cells. Sci. Immunol. 4, eaaw0902.
-
科技前沿