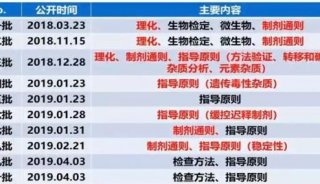
2020年版《中國藥典》三部細菌制品增修訂概況
根據第十一屆國家藥典委員會全體會議通過的2020?年版《中國藥典》編制大綱,經各課題承擔單位起草、復核和疫苗制品專業委員會審核,完成了《中華人民共和國藥典》?(以下簡稱《中國藥典》)2020年版三部細菌性疫苗的制修訂,目前《中國藥典》2020年版已正式出版,現將細菌性疫苗的主要增修訂情況介紹如下,為新版藥典實施提供參考。
1??品種遴選及收載情況
按照國家藥品監督管理局官網可查詢的信息,我國目前已上市的細菌性疫苗基本已納入《中國藥典》2015版收載,未收載的已上市細菌性疫苗為數非常有限,主要局限于肺炎多糖疫苗以及以百白破疫苗為基礎的聯合疫苗,且部分聯合疫苗為未在國內生產的進口注冊產品。依照國家藥品標準制修訂工作程序,將《中國藥典》2015版未收載的已上市細菌性疫苗品種,提交《中國藥典》第十一屆藥典委員會疫苗專業委員會和醫學專業委員會,按照“安全有效、質量可控”的總體原則,從藥學和醫學兩個方面分別進行遴選和審議,確定將23價肺炎球菌多糖疫苗、無細胞百白破b型流感嗜血桿菌聯合疫苗(DTaP-Hib)和治療用卡介苗等3?個品種作為《中國藥典》2020?年版三部擬新增品種,經我委標準提高課題立項,課題承擔單位的研究,專業委員會審議通過后正式收載于本版藥典。
2??新增品種概述
2.1? 23價肺炎球菌多糖疫苗
該疫苗采用1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F型肺炎鏈球菌分別進行液體培養,經提取和純化獲得莢膜多糖抗原稀釋合并制成。用于預防由本疫苗包含的23種肺炎鏈球菌血清型引起的肺炎、腦膜炎、中耳炎和菌血癥等疾病。
據世界衛生組織估計,肺炎鏈球菌感染在全球每年可致數百萬兒童死亡,在國內也是引起嬰幼兒和老年人肺炎發病和死亡的重要原因之一,盡管該疫苗目前未納入國家免疫接種規劃(EPI),為自費接種疫苗,隨著公眾對公共衛生安全的普遍關注,以及疾病負擔的實際情況,近年來越來越多用于2歲以上兒童、老年人以及患有慢性疾病的高風險人群接種。
該品種目前由三家企業生產,首次上市時間為2006年,此后,又相繼批準了其他2家國內上市申請,該品種上市以來,由于其工藝和質控方面尚需進一步完善,因此未能及時納入《中國藥典》2010年版和2015年版收載。該品種均已在《歐洲藥典》(EP)和《英國藥典》(BP)收載。
首家上市的該品種為單劑量添加抑菌劑(苯酚)疫苗,后期上市的其它兩家同品種均未添加抑菌劑。按照《中國藥典》三部凡例和制劑通則規定,單劑量注射液原則上不得添加抑菌劑,為保證該疫苗目前市場應用情況,本版藥典收載的23價肺炎球菌多糖疫苗盡管保留了成品檢定中苯酚抑菌劑檢查,對于相關生產企業而言,后期應進一步優化生產工藝去除抑菌劑,提高產品質量和安全性。
與現行版EP[1]同品種標準相比,本版藥典收載的23價肺炎球菌多糖疫苗在安全性和質量可控性方面更加嚴格。在單型精制多糖檢定項下,EP的質量控制項目包含鑒別試驗和特異性試驗,本版藥典標準中除鑒別試驗、各型多糖含量和多糖分子大小等化學檢定項目外,還規定了相關工藝雜質,如有機溶劑殘留量檢測和細菌內毒素檢查,以保證疫苗的安全性;半成品檢定和成品活性成分的(各型多糖)鑒別和含量測定檢定項均與EP一致;本版藥典成品異常毒性檢查和細菌內毒素檢查和滲透壓摩爾濃度檢查項,在EP中無相應要求。由于本品含23型肺炎球菌多糖,多糖含量測定(速率法)需涉及23種多糖和抗血清的國家標準品,基于各種客觀條件的限制,目前以上國家標準品尚未全部制備和建立,新版藥典實施過程中需進一步完善國家標準物質,以保證該疫苗與有效性相關的活性成分的質量控制。
2.2??無細胞百白破b型流感嗜血桿菌聯合疫苗
無細胞百白破b型流感嗜血桿菌聯合疫苗是由吸附無細胞百白破聯合疫苗和b型流感嗜血桿菌結合疫苗組成,使用前混合,用于預防b型流感嗜血桿菌引起兒童的感染性疾病以及百日咳桿菌、白喉桿菌、破傷風梭狀芽孢桿菌引起的百日咳、白喉和破傷風等疾病。
多年來,聯合疫苗一直為世界衛生組織和我國政府倡導,其優勢在于可減少接種針次,提高疫苗接種的依從性,從而提高接種率并減少發生疑似異常反應的可能。目前全球已上市的聯合疫苗幾乎均為聯合的各疫苗抗原成分混合一體的形式,本品種以兩個單獨包裝的疫苗成分臨用時混合的方式目前在全球并不常見。本品是《中國藥典》首次收載的針對4種不同傳染性疾病的四聯疫苗。該品種于2012年在國內首次批準上市,目前由2家生產企業生產。
該品種由2種單獨的疫苗組成,疫苗標準分別執行本版藥典收載的b型流感嗜血桿菌結合疫苗和無細胞百白破聯合疫苗的相關要求。各單個疫苗質量控制的相關要求與現行版EP?[2]收載的同品種基本一致。
2.3??治療用卡介苗
治療用卡介苗是用卡介菌經培養收集菌體,制備成高濃度卡介菌懸液,再加入適宜的穩定劑凍干制成,是一種免疫治療劑,?主要用于膀胱原位癌手術后的治療和預防復發。
該品種于2012年首次批準上市,為《中國藥典》收載的第一個治療性疫苗,也是第一個以細菌為載體的基因治療產品。該品種已在EP收載。
與現行版EP[3]收載的同品種標準相對比,本版藥典標準除了EP規定的鑒別實驗、水分含量、活菌數、細菌濃度、純菌檢查和無有毒分支桿菌檢查外,增訂了毒性檢查項目,以提高制品安全性,增訂了與效力相關的遲發型超敏試驗、脾激活試驗與抑瘤試驗,以提高對有效性的控制。與EP相比,本版藥典的此項標準在安全性和有效性方面更加嚴格。現行版EP除規定活菌數檢查項以外,無其他涉及有效性的檢查項和指標要求,《中國藥典》基于已批準上市產品的質量控制要求,規定采用抑瘤試驗用于該品種有效性控制,國內上市產品原批準的方法為采用艾氏腹水瘤導致小鼠致瘤并產生腹水后,用治療用卡介苗連續治療,計算動物的生命延長率,生命延長率大于75%判為合格,該方法為動物體內試驗,周期長,重復性差,同時,該動物模型的給藥方式和對抑瘤的評價方式,與治療用卡介苗的用藥方式和抑制腫瘤復發的用途關聯性不強,不適合作為評價本品有效性質量控制的指標。基于本品抑制腫瘤復發的機制可能與卡介苗在局部形成炎癥因子或直接接觸并抑制癌細胞生長有關,因此通過對實體瘤的抑瘤作用更能直觀反映本品的有效性,基于本品臨床用途,同時參考進口注冊批準的同品種其抑瘤試驗相關要求,采用實體瘤模型,將腫瘤細胞與藥物同時給藥的方式建立了該品種的有效性控制方法,并以試驗組與對照組瘤重差異作為結果判定依據,使方法的評價指標更客觀、明確,重現性更好。
3??增修訂品種情況
3.1??共性增修訂內容
3.1.1??疫苗使用說明
基于疫苗的特殊性,從第一版國家標準以來,疫苗使用說明一直作為品種標準的一部分在國家標準中收載,歷版國家標準收載的使用說明,對于規范疫苗使用,避免接種過程的錯誤和不良反應的發生等,發揮了重要的作用;但隨著政府管理職能的分割,以及我國相關監管部門對免疫接種工作的不斷規范和疫苗接種后不良反應監管力度的加大,《中國藥典》對使用說明更新的滯后,加之藥學質量標準與使用說明中涉及免疫接種程序、不良反應等醫學范疇分屬不同的管理體系,《中國藥典》繼續收載使用說明對疫苗上市后管理帶來的問題日益凸顯,經第十一屆藥典委員會疫苗專業委員會的充分評估和分析,以及與國家局相關管理部門和藥品審評機構的溝通協調,確定本版藥典疫苗各論項下不再收載使用說明,為保證相關工作和內容的銜接,本版藥典“人用疫苗總論”中增加或保留相關原則性說明,具體要求應符合國家相關規定。此外為保護疫苗接種者的安全,強調應依據同品種疫苗上市后監測情況等資料及時更新使用說明中不良反應、禁忌、注意事項等相關內容。
3.1.2??規范文字表述
本版藥典進一步規范了收載內容的文字表述,同時有利于與國際標準或相關技術要求的協調統一,對于細菌性疫苗相關檢定項目,如含鋁佐劑疫苗成品檢定中鋁佐劑含量,多年來在藥典中一致以氫氧化鋁含量表示,與歐洲藥典和世界衛生組織技術規范表述不一致,不利于質量標準的分析比較,本版藥典統一修訂為按鋁含量表示,單位為mg/劑;此外,對于疫苗中防腐劑含量、有機溶劑殘留量單位統一由“mg/L”修訂為“mg/劑”,與國內外其他相關技術要求保持一致。
3.2??品種各論增修訂內容
3.2.1??佐劑疫苗增訂吸附效果的控制
吸附白破二聯疫苗和吸附無細胞百白破聯合疫苗為氫氧化鋁佐劑吸附疫苗,氫氧化鋁為兩性化合物,等電點為11.4,在中性pH條件下帶正電荷,可很好的吸附帶負電的蛋白抗原,形成沉淀。當其接種到機體內后形成?“抗原庫”,緩慢釋放出抗原,延長抗原的作用時間,達到免疫增強的作用,因此,佐劑對抗原吸附能力的強弱直接影響產品的有效性[4]。近年來該疫苗的常規監管中,多次發現因佐劑吸附均一性問題,導致產品有效性和穩定性出現異常的情況。
基于該疫苗質量控制的相關問題,結合國外藥典和相關技術要求,本版藥典在半成品檢定項下增設了佐劑吸附率檢查項,具體方法為采用Lowry法分別測定疫苗上清游離抗原量和疫苗總抗原含量,計算吸附率,限度標準分別為不低于90%和95%。
3.2.2??增訂鉤端螺旋體疫苗菌種分子鑒別檢查
鉤端螺旋體疫苗的菌種,由于無法凍干保存,需要定期傳代動物保持毒力,傳代過程中可能存在基因組發生變異,從而改變疫苗免疫原性和安全性的風險。本版藥典在鉤端螺旋體疫苗菌種檢定項增訂分子鑒別試驗,提高菌種檢定的特異性,同時亦可考察菌種傳代過程中的遺傳穩定性。
3.2.3??微生態制品總論
微生態制品的安全試驗起源自微生態制劑異常毒性試驗方法[5],通過給小鼠灌胃微生態制品溶液檢查制品在生產過程中可能引入的外來污染物的非正常毒性反應[6]。微生態制品為口服制劑,按照《中國藥典》2015年版制劑通則的要求,口服制劑不需進行異常毒性檢查,同時,現行版USP[7]和EP[8]對微生態活菌產品也不要求進行上述檢查;此外,由于多年來實施GMP對藥品生產過程的控制,基本避免了正常生產過程中引入外來污染物的風險,基于以上考慮,本版藥典取消微生態制品的安全試驗檢查項。
3.2.4??簡化產品重復質量屬性檢查項目的要求
《中國藥典》2015年版對b型流感嗜血桿菌結合疫苗成品檢定項要求同時進行滲透壓摩爾濃度和氯化鈉含量測定,由于滲透壓摩爾濃度主要測定制品的晶體滲透壓,而該疫苗系由氯化鈉注射液稀釋多糖蛋白結合物制成,制品的晶體滲透壓由氯化鈉產生,因此滲透壓摩爾濃度可間接反應氯化鈉的濃度,為避免對同一質量屬性設定不必要的重復檢查項目,本版藥典取消氯化鈉含量測定項。
4??小結
本版藥典在上版藥典的基礎上收載品種數量進一步增加,標準不斷提高,體現了藥典編制過程貫穿始終提高制品的安全、有效以及質量可控性原則;在藥典在修訂過程中,參考國際先進標準,充分與國外藥典、國內外相關技術指導原則進行比對,采納了國外標準合理的內容,實現生物制品標準緊跟科技發展前沿,與國際先進水平基本保持一致,與國際標準更加協調,標準的合理性進一步提高。
與此同時,還應看到,本版藥典對于分析方法的更新換代還需進一步開展研究,與國外先進技術要求存在一定差距,如中國藥典收載的多糖結合疫苗中多糖型別的鑒別、多糖分子大小測定等,多年來一直采用傳統的色譜法,而歐洲藥典等國外藥典已采用成熟的質譜方法;此外,本版藥典對于疫苗工藝雜質的控制方面,參考ICH[9]在“人用疫苗總論”中對雜質控制增訂了相關原則性要求,一方面將工藝相關雜質和產品相關雜質進行了區分,同時對工藝雜質要求的合理性進行了完善,對于與疫苗關鍵質量屬性相關的工藝雜質延續上一版藥典的要求,而對于一般工藝雜質,本版藥典增訂“在經充分驗證證明生產工藝可對其有效、穩定的去除或控制,并持續達到可接受的水平或殘留水平處于分析方法的檢測限以下時,一般工藝雜質的殘留物檢測可不列入產品的檢定項目中”的要求;但對于現行版中國藥典收載的部分各論,尚未完全體現以上原則,需要進一步開展對疫苗雜質的來源、分類、以及雜質去除工藝、雜質特性分析方法等研究,進一步細化具體疫苗品種工藝雜質的分類和要求,完善標準的嚴謹性、合理性。
參考文獻
[1]? EP 10.0[S]. 2020:1021
[2]? EP 10.0[S]. 2020:961
[3]? EP 10.0[S]. 2020:948
[4]??王曉娟,馬銳,曹琰,等.鋁佐劑及佐劑吸附疫苗質量標準的探討[J].?中國生物制品學雜志,2019,32(4):485
WANG XJ,?MA R,?CAO Y,?et al. Discussion on the quality standards of aluminum adjuvant and adjuvant adsorption vaccine [J]. Chin J Biol,?2019,?32(4):485
[5]??中國生物制品標準化委員會.中國生物制品規程2000年版[M].?北京:化學工業出版社.2000:424
Chinese Committee for Standardization of Biological Products. Chinese Biological Products Regulations 2000[M]. Beijing:?Chemical Industry Press. 2000:424
[6]??王曉娟,趙勇,曹琰,等.?疫苗異常毒性檢查及相關問題探討[J].?中國生物制品學雜志,2020,33(6):722
WANG XJ,?ZHAO Y,?CAO Y,?et al. Abnormal toxicity test of vaccines and their related problems [J]. Chin J Biol,?2020,?33(6):722
[7]? USP 43-NF38[S]. 2020:6477
[8]? EP 10.0[S]. 2020:876
[9]? ICH. Guideline for Elemental Impurities Q3D(R1),?2019,?https://database.ich.org/sites/default/files/Q3D-R1EWG_Document_Step4_Guideline_2019_0322.pdf
-
標準
-
標準
-
標準

-
會議會展